中大新聞中心
中大研發神經退化性疾病抑制劑為治療polyQ疾病帶來曙光
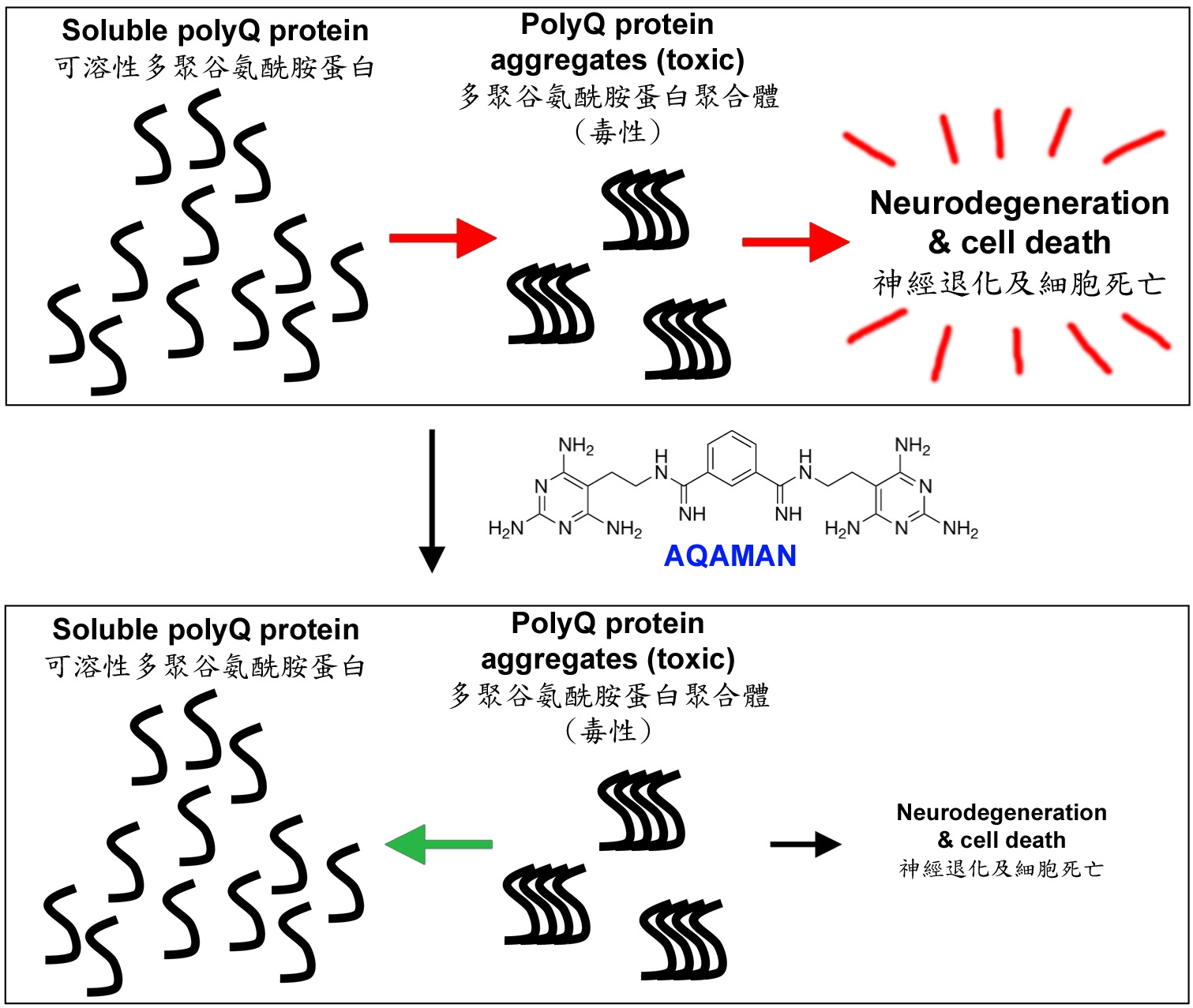
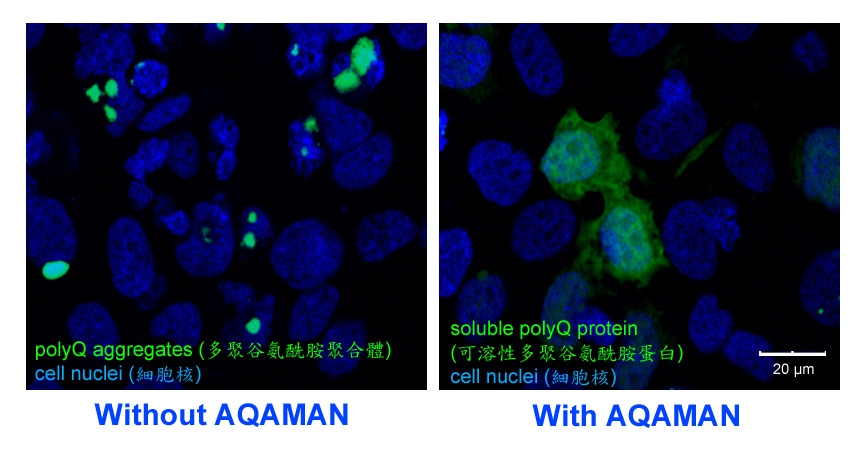
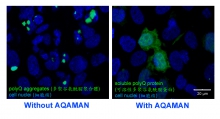
香港中文大學(中大)生命科學學院教授陳浩然教授及其研究小組發現了一種名為Anti-polyQ Aggregation for Machado-Joseph-Associated Neurodegeneration(AQAMAN)的小分子化合物,能有效解離有毒蛋白質聚集體,抑制神經退化。AQAMAN可望被開發成藥物,用作治療馬查多–約瑟夫病(Machado-Joseph Disease,一種最常見的脊髓小腦性共濟失調,簡稱小腦萎縮症或SCAs)及其他多聚谷氨酰胺(polyQ)疾病,為患有這類疾病的病人帶來新希望。陳教授的研究成果最近獲《生物化學期刊》(Journal of Biological Chemistry)作為封面文章發表。
自1999年,陳教授一直研究polyQ疾病(一組罕見的神經系統疾病,包括SCAs),並開發針對這些疾病的治療干預措施。SCAs令病人小腦中的神經細胞逐漸死亡,以致手腳肌肉失去控制、步態不穩、言語不清等。一般而言,polyQ疾病患者將逐漸喪失精細運動功能,難以保持平衡或協調日常運動。迄今為止,polyQ疾病仍然無法治癒。
中大發現AQAMAN有助治療polyQ疾病
陳教授與來自丹麥、法國、意大利、英國和美國的研究人員展開了國際研究合作,共同管理有關SCAs及其他罕見神經與神經肌肉疾病的多學科研究項目,當中他與Steven C. Zimmerman教授(美國伊利諾伊大學厄巴納–香檳分校)緊密合作。Zimmerman教授是合成化學專家,專注於篩選針對罕見疾病(包括SCAs和強直性肌肉營養不良症)的候選藥物。小分子化合物AQAMAN便是由Zimmerman教授的團隊生產,原定用於治療強直性肌肉營養不良症(一組肌肉萎缩/退化疾病)。陳教授的團隊偶然發現AQAMAN對polyQ疾病亦有潛在療效。PolyQ疾病是一組由蛋白質聚合體引發的神經退行性疾病,而AQAMAN能干擾polyQ蛋白質聚合體形成,並促使已形成的聚合體分解。陳教授的團隊目前正在尋求藥廠為合作夥伴,以進一步改善AQAMAN的藥性。
陳教授說:「錯誤折疊和聚集的蛋白質與多種人類疾病密切相關。自1999年以來,我一直研究polyQ蛋白聚合體如何導致神經細胞退化,並試圖以遺傳策略來干預有毒polyQ聚合體的形成。自2012年起,我與Zimmerman教授合作,使用果蠅Drosophila作為藥物篩選模型,用來測試及評估不同的小分子化合物對醫治強直性肌肉營養不良症的效果。後來在2016年,我與管進教授(中大生命科學學院)合作,使用果蠅的神經肌肉接頭來研究強直性肌肉營養不良症的疾病機制。AQAMAN是眾多基於雙脒的抑制劑之一,原本是用來抑制強直性肌肉營養不良症中的核糖核酸–蛋白複合物。但出乎我們預期,AQAMAN竟然具有干擾有毒蛋白質聚集的能力。我們希望進一步研發AQAMAN作臨床治療用途,為polyQ疾病患者帶來希望。」
是項研究獲中大校長備用基金、中大呂志和創新醫學研究所、中大蔡永業腦神經科學中心、裘槎基金會、美國國家衞生研究院,以及香港小腦萎縮症協會的捐款資助。
改良型多肽抑制劑能對抗神經退化疾病的 RNA毒性
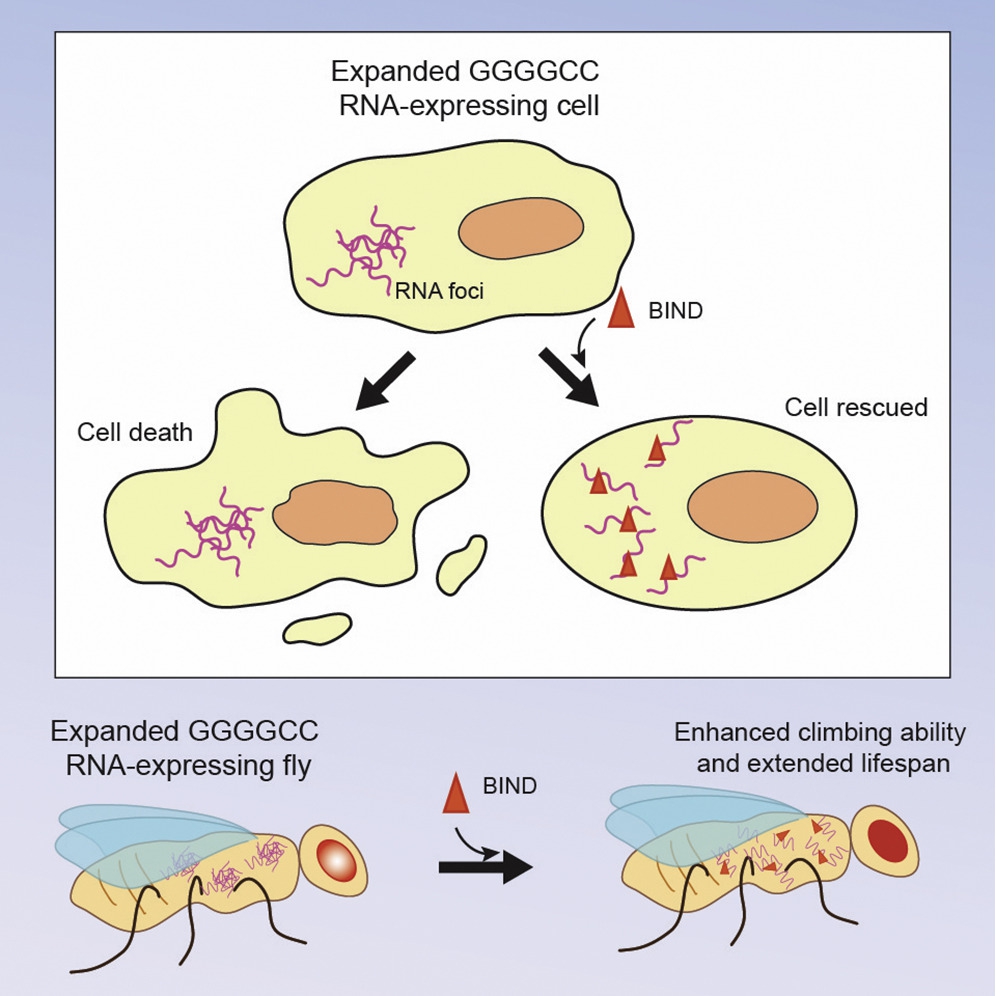
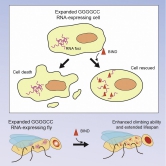
2016年,陳教授與中大生命科學學院敖志祺教授合作,致力開發一種新型多肽抑制劑,用於抵抗polyQ疾病的CAG RNA毒性。敖教授是一位結構生物學家和資深的藥物研發專家。團隊最近發現了一種由21個氨基酸組成的多肽分子,作為用於神經退化性疾病的改良型多肽抑制劑,並命名為BIND。這種抑制劑能針對polyQ疾病和C9orf72-相關的肌萎缩性脊髓側索硬化症(又名漸凍人症)/ 額顳葉型失智症(C9ALS / FTD)的RNA毒性。有關polyQ和C9ALS / FTD的發現已分別在RNA 及Molecular Therapy–Nucleic Acids兩本期刊中發表(Zhang et al., (2018); Zhang et al., (2019) 印製中)。
敖教授說:「自2016年以來,陳教授和我一直努力進一步優化我們的多肽類RNA毒性抑制劑。polyQ疾病中的RNA毒性由CAG重複擴增引起,而C9ALS / FTD中的RNA毒性則由GGGGCC重複擴增引起。GGGGCC是在人類基因組中的一種六核苷酸重複DNA序列,不受控制的GGGGCC重複擴增會導致C9ALS / FTD罕見疾病。儘管polyQ和C9ALS / FTD具有不同的RNA毒性疾病機制,但我們的生物物理研究清楚地證明了BIND可以抑制兩種不同類型的毒性並減輕神經退化。我們計劃進一步優化BIND的穩定性和腦靶向性,將研究帶入臨床前階段。」
2月28日是罕見疾病日。此全球性活動首次於2008年舉辦,旨在提高公眾與罕見病決策者對患者生活的關注。香港脊髓小腦共濟失調協會於2007年設立,並於2015年成立香港罕見疾病聯盟,為病人及其家人提供支援,並促進社區對罕見疾病的認識。
陳浩然教授簡歷
陳浩然教授是中大生命科學學院的教授。他獲中大生物化學理學士學位,並先後於英國劍橋大學及美國賓夕法尼亞大學接受博士及博士後培訓。自1999年以來,陳教授一直在研究罕見神經系統疾病的致病途徑。他對這一領域的貢獻得到了學術界的認可,獲頒授多個研究獎項,包括中大青年學者研究成就獎和中國遺傳學會第13屆李汝祺動物遺傳學獎。陳教授是香港青年科學院的創始成員及執行委員會成員,並於香港脊髓小腦共濟失調協會和香港罕見疾病聯盟擔任顧問。
管進教授簡歷
管進教授是中大生命科學學院果蠅研究實驗室的研究助理教授和副主任。他獲美國波士頓學院的生物化學本科培訓、馬薩諸塞大學醫學院的博士培訓及澳洲昆士蘭大學的博士後培訓。管教授使用果蠅神經肌肉接頭研究突觸可塑性和發育神經生物學。自2016年以來,他的研究興趣擴展到神經肌肉疾病的潛在機制,如強直性肌肉營養不良症。他是美國神經科學學會的活躍成員。
敖志祺教授簡歷
敖志祺教授是中大生命科學學院助理教授。他在美國加州大學聖地亞哥分校獲得化學學士學位和生物化學博士學位,並在美國哈佛醫學院貝絲以色列女執事醫療中心接受博士後培訓。敖教授研究控制pre-mRNA剪接的蛋白質的結構/功能關係。自2011年以來,他的研究興趣擴展至包括癌症和神經退化性疾病藥物靶標的研發和中分子靶標抑制劑的開發。他是美國RNA協會和美國生物化學與分子生物學學會的活躍成員。