中大新聞中心
中大揭示幽門螺旋桿菌在人體胃部存活之秘拓新方案以滅絕引致胃潰瘍及胃癌之元兇
香港中文大學(中大)生命科學學院蛋白質科學與晶體研究中心黃錦波教授及其研究團隊最近發表一項研究結果,揭示了幽門螺旋桿菌(Helicobacter pylori)如何在人體胃部的酸性環境中生存。幽門螺旋桿菌可引致消化性潰瘍甚至胃癌,現時全球已有一半人口受感染。此項研究成果有助研發治療幽門螺旋桿菌感染的新藥物,獲選為學術期刊Journal of Biological Chemistry的「本周最佳論文」。
幽門螺旋桿菌是已知唯一能在胃酸中生長的細菌,它會損害腸道黏膜,導致消化性潰瘍及引起胃炎。現有的抗生素可以治癒八至九成由病菌引致的潰瘍,但隨著幽門螺旋桿菌的抗藥性與日俱增,抗生素會逐漸失效,故必須及早開發新的藥物來對抗幽門螺旋桿菌的感染。
黃錦波教授的研究生方宇亨同學指出,幽門螺旋桿菌能在胃酸中生存,是由於它可生產尿素酶以分解在胃內的尿素,使之釋放出氨,從而中和胃酸。然而,與其他大多數酶不同的是,尿素酶由病菌產生後,不可直接發揮其作用;它需要接收到兩個鎳離子以後,才可轉化為有活性的酶。
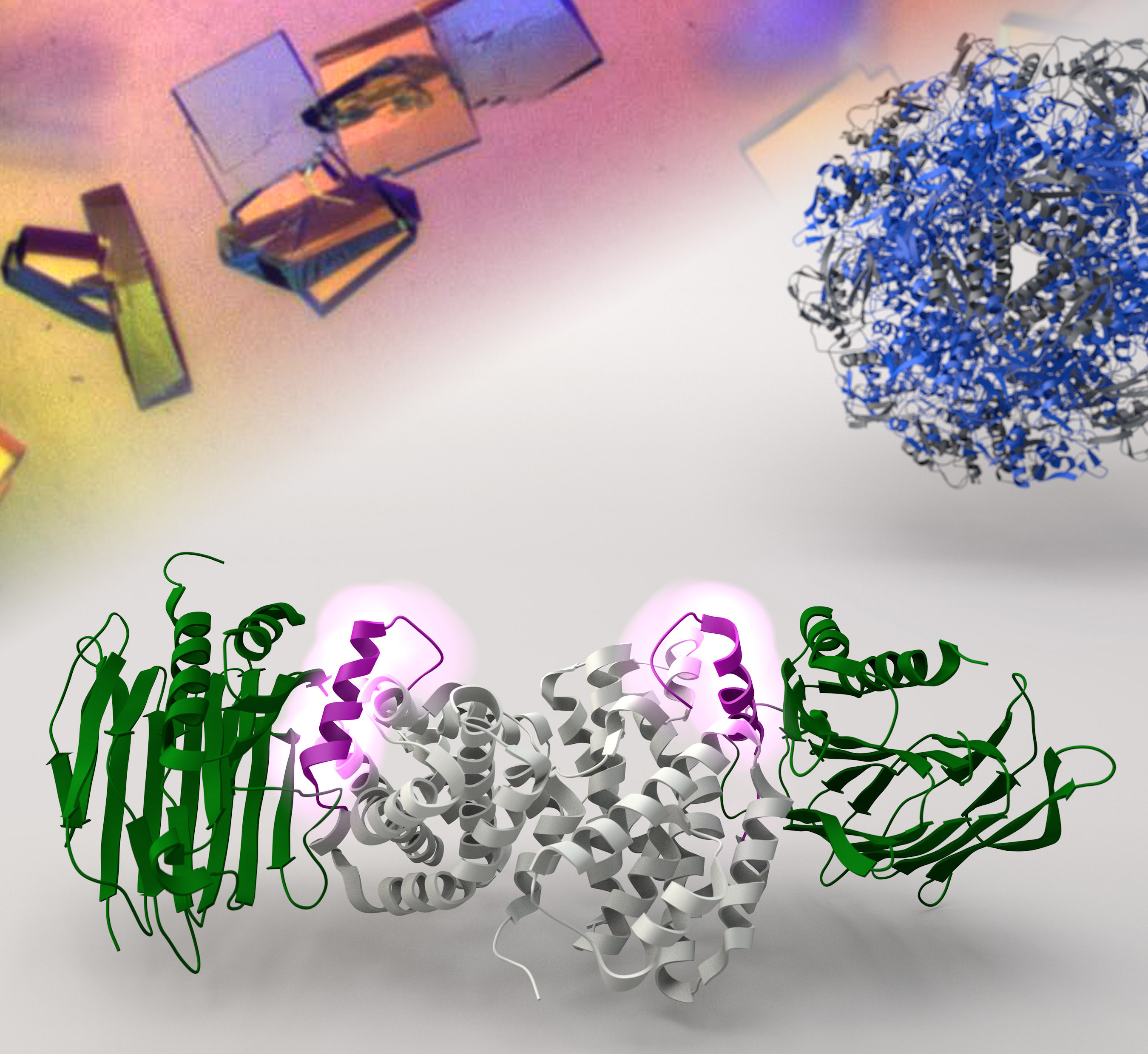
「由於幽門螺旋桿菌的生存取決於有活性的尿素酶,因此對病菌而言,鎳離子能否運送到尿素酶實屬生死攸關的事。」黃教授說。他的團隊便致力研究四個輔助激活尿素酶的蛋白質:UreE、UreF、UreG和UreH。他們利用X射線晶體學技術,產生像顯微鏡一樣的效果,以觀察蛋白質的分子結構。他們發現了UreF、UreH和UreG這三個輔助蛋白如何自行集結成一個分子機器,將鎳離子運送到尿素酶。鎳離子一旦到位,尿素就會被分解為氨,從而中和胃酸。
更重要的是,他們證實了破壞UreF-UreH-UreG分子機器的形成能抑制活性尿素酶的合成。「現在我們知道這分子機器是如何進行自我組裝,就能想辦法把它拆解。由於活性的尿素酶是幽門螺旋桿菌賴以生存的關鍵,以這個分子機器為標靶而開發的藥物,很有可能是根除致病菌的新策略。」黃教授說。根據這些發現,研究小組正在設計新藥以抑制該分子機器的自我組裝,滅絕幽門螺旋桿菌在胃酸中存活的機會。